CAR-T: utilizzo dell’mRNA per applicazioni “in vivo”

Nella tecnologia CAR-T, progettare i recettori dell’antigene chimerico (CAR) o i recettori delle cellule T (TCR) aiuta a creare cellule T specifiche per una terapia mirata per la cura di una malattia, ma il costo e il rigore associati alla produzione di cellule T ingegnerizzate ex vivo possono essere proibitivi, quindi la programmazione delle cellule T in vivo può essere una valida alternativa.
CAR-T technology
CAR-T è una potente modalità in cui le cellule T estratte da un paziente o da un donatore vengono geneticamente modificate per colpire tumori o agenti infettivi. L’efficacia di questa tecnica è supportata da numerosi studi clinici, che mostrano risultati impressionanti. La complessità e i costi elevati legati alla produzione di un prodotto a base di cellule T su misura per ciascun paziente, tuttavia, rendono difficile competere con opzioni terapeutiche di prima linea come i farmaci o anticorpi monoclonali.
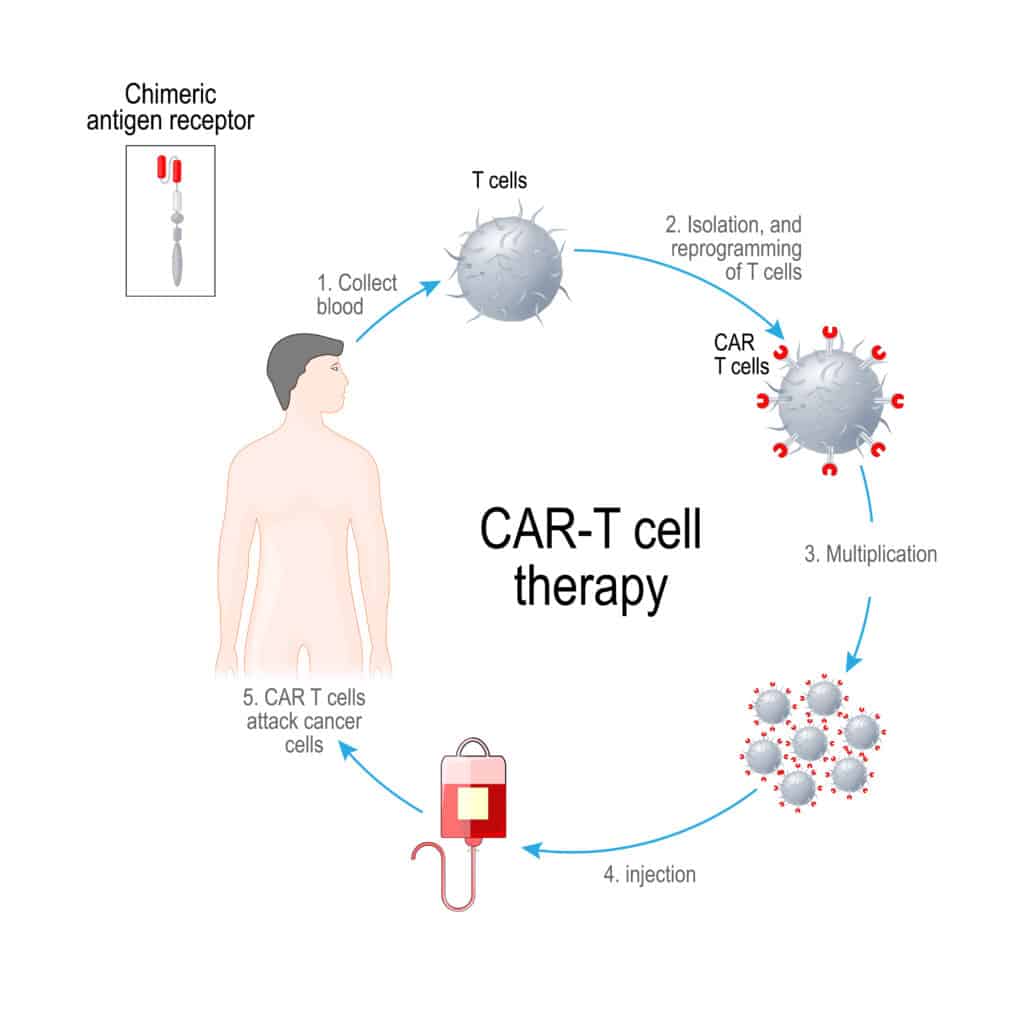
La maggior parte delle cellule T CAR-T e TCR sono attualmente prodotte mediante un processo complicato che prevede: estrazione di cellule T da un paziente; attivazione e trasduzione delle cellule T; espansione delle cellule T trasdotte; lavaggio e concentrazione delle cellule T prima della somministrazione. L’intero processo deve essere condotto in condizioni appropriate e strettamente controllate. Poiché ciascun prodotto CAR-T è costituito da materiali di partenza (cellule T) provenienti dal paziente da trattare, non esistono economie di scala.
Utilizzo dell’mRNA
L’mRNA trascritto in vitro (IVT) è emerso come una nuova classe di farmaci che può essere utilizzata per codificare proteine di interesse terapeutico direttamente in vivo. Le molecole sintetiche di mRNA possono essere rapidamente progettate, manipolate e prodotte in serie in modo relativamente conveniente. Negli ultimi decenni, gli scienziati hanno imparato come ottimizzare l’mRNA dal punto di vista farmacologico e immunologico per renderlo più simile a un farmaco per applicazioni cliniche.

E’ stato studiato l’uso dell’mRNA IVT per programmare in modo rapido e specifico le capacità di riconoscimento dell’antigene nelle cellule T circolanti come strategia per trattare il cancro e malattie infettive. A differenza dei nanovettori di DNA, le molecole di mRNA sintetico vengono tradotte direttamente in proteine bersaglio terapeutiche senza la necessità di entrare nel nucleo, garantendo elevati tassi di trasfezione e rapidi effetti terapeutici.
La semplice iniezione di nanovettori di mRNA progettati razionalmente può fornire selettivamente geni CAR o geni TCR nelle cellule T ospiti e programmarli in quantità sufficienti a provocare la regressione della malattia con una buona efficacia. Numerosi studi clinici in corso stanno testando infusioni ripetute di cellule T CAR mRNA ingegnerizzate ex vivo in pazienti affetti da cancro e i primi dati suggeriscono che l’espressione transitoria di CAR dopo l’infusione cellulare sia sufficiente per innescare risposte antitumorali.
Vantaggi nell’utilizzo dell’mRNA
Tre ragioni importanti per cui l’mRNA IVT è rapidamente emerso come nuovo strumento per la terapia adottiva con cellule T sono:
- La sua sicurezza intrinseca;
- La sua traduzione proteica ricombinante altamente efficiente;
- La capacità di controllare le proprietà farmacocinetiche della terapia, simile a un farmaco convenzionale a piccole molecole.
Sebbene la programmazione in situ acquisisca la capacità di controllare le proprietà farmacocinetiche della terapia e di riprogrammare periodicamente nuove popolazioni di linfociti ospiti, aggirando così potenzialmente alcuni dei principali ostacoli a un più ampio impiego delle terapie con cellule T (esaurimento e disfunzione delle cellule T, tossicità a lungo termine), la tecnologia presenta ancora alcune limitazioni:
- Si basa sulla presenza di un numero sufficiente di cellule T funzionali nei pazienti;
- L’efficacia del farmaco potrebbe essere attenuata dalle risposte immunitarie suscitate.
Per la traduzione clinica di questa tecnologia, sarà importante scegliere ligandi bersaglio CD8 completamente umanizzati, fornire costrutti CAR/TCR che comportino un basso rischio immunologico e sintetizzare l’mRNA con pseudouridina e 5-metilcitosina per ridurre le risposte immunitarie innate.
Limitazioni degli anticorpi bispecifici
Per reindirizzare le cellule T circolanti verso le cellule tumorali residenti in situ, diversi produttori di farmaci biotecnologici hanno sviluppato anticorpi bispecifici. Tra questi, Blinatumomab (un BiTE specifico per CD19) ha mostrato risultati incoraggianti negli studi clinici su pazienti affetti da neoplasie ematologiche. I BiTE, tuttavia, devono essere somministrati come infusione continua, che può produrre tossicità sistemiche. Inoltre, come gli anticorpi monoclonali convenzionali, i BiTE non subiscono biodistribuzione attiva o autoamplificazione dopo l’infusione. Al contrario, il sistema di modificazione genetica basato su nanoparticelle può generare cellule T specifiche per il tumore de novo, che, come un “farmaco vivente”, si localizzano attivamente sul bersaglio, aumentano di numero e distruggono in serie le cellule tumorali.
CAR-T e prospettive future
I metodi attuali per generare cellule T specifiche per malattie in vitro sono elaborati e non possono supportare il trattamento di grandi popolazioni di pazienti, poiché è necessario produrre una nuova coorte di linfociti per ciascun paziente. Diverse aziende produttrici di cellule T in fase clinica hanno iniziato a testare le cellule T CAR prodotte come prodotti “pronti all’uso” da donatori sani non imparentati, piuttosto che dal paziente.
Sebbene questo approccio consenta il trattamento di pazienti affetti da cancro per i quali non sia possibile produrre cellule T autologhe a causa della bassa conta dei linfociti del paziente o della scarsa qualità delle cellule T, richiede diversi passaggi aggiuntivi di ingegneria cellulare, per impedire alle cellule del donatore di attaccare l’ospite oppure per impedire alle cellule T del paziente di rifiutare il prodotto infuso. Queste ulteriori manipolazioni aggiungono complessità, tempo e costi al processo di produzione, riducendo al contempo la resa e la vitalità delle cellule.

A differenza delle terapie già consolidate in clinica, come piccole molecole o anticorpi, le nanoparticelle per la programmazione CAR sono costrutti tridimensionali multicomponente, che richiedono un processo di produzione riproducibile per ottenere in modo affidabile le caratteristiche fisico-chimiche, i comportamenti biologici e i profili farmacologici desiderati. La sicurezza e l’efficacia di tali nanomedicinali possono essere influenzate da piccole variazioni di molti parametri e devono essere attentamente monitorate, in particolare nel contesto del targeting verso siti non previsti e potenziali tossicità. Le nanomedicine, inoltre, richiedono ulteriori considerazioni di sviluppo e di regolamentazione rispetto alle medicine convenzionali.
